Elektronszívó csoportokkal β-helyzetben szubsztituált alaninok előállítása és enzimkinetikai vizsgálata
Az aminosavak és a belőlük felépülő fehérjék az élővilág talán legfontosabb építőkövei. Fehérjék alkotják részben vagy egészben például az élő szervezetek vázanyagait, receptorait, transzportereit, energiatároló anyagait, illetve az enzimeket is, melyek a szervezetekben lejátszódó kémiai folyamatok biokatalizátorai.
Biotranszformáció során egy molekula kémiai változáson esik át egy organizmus vagy izolált enzim segítségével. Ezen folyamatok felhasználása nagy múltra tekint vissza, már az ókorban is élelmiszerek előállítását végezték velük. Ipari léptékű felhasználásuk viszont a XX. század közepén indult meg igazán, amit jól példáz a penicillin fermentációs eljárással való előállítása. Azóta a biotranszformációs (vagy más néven biokatalitikus) folyamatok tanulmányozása és alkalmazása külön tudományággá nőtte ki magát, melyet biotechnológiának nevezünk. Ez a biokémiát, biológiát és a mérnöki tudományokat egymásba olvasztó diszciplína korunk egyik legdinamikusabban fejlődő tudományterülete, mely felhasználásra talált a gyógyszeriparban, a mezőgazdaságban és a környezetvédelemben is.
Gyógyszeripari jelentősége megkérdőjelezhetetlen, a királis gyógyszerhatóanyagok szintézisútjába való biokatalitikus lépések beiktatása mindennapossá vált a mai gyógyszergyártók körében.[1][2] Ezen eljárásokkal elkerülhetőek a pénz- és időigényes rezolválások, melyek során a hatásos izomer elválasztását végezzük a kevésbé effektív, illetve gyakran toxikus izomer(ek)től.
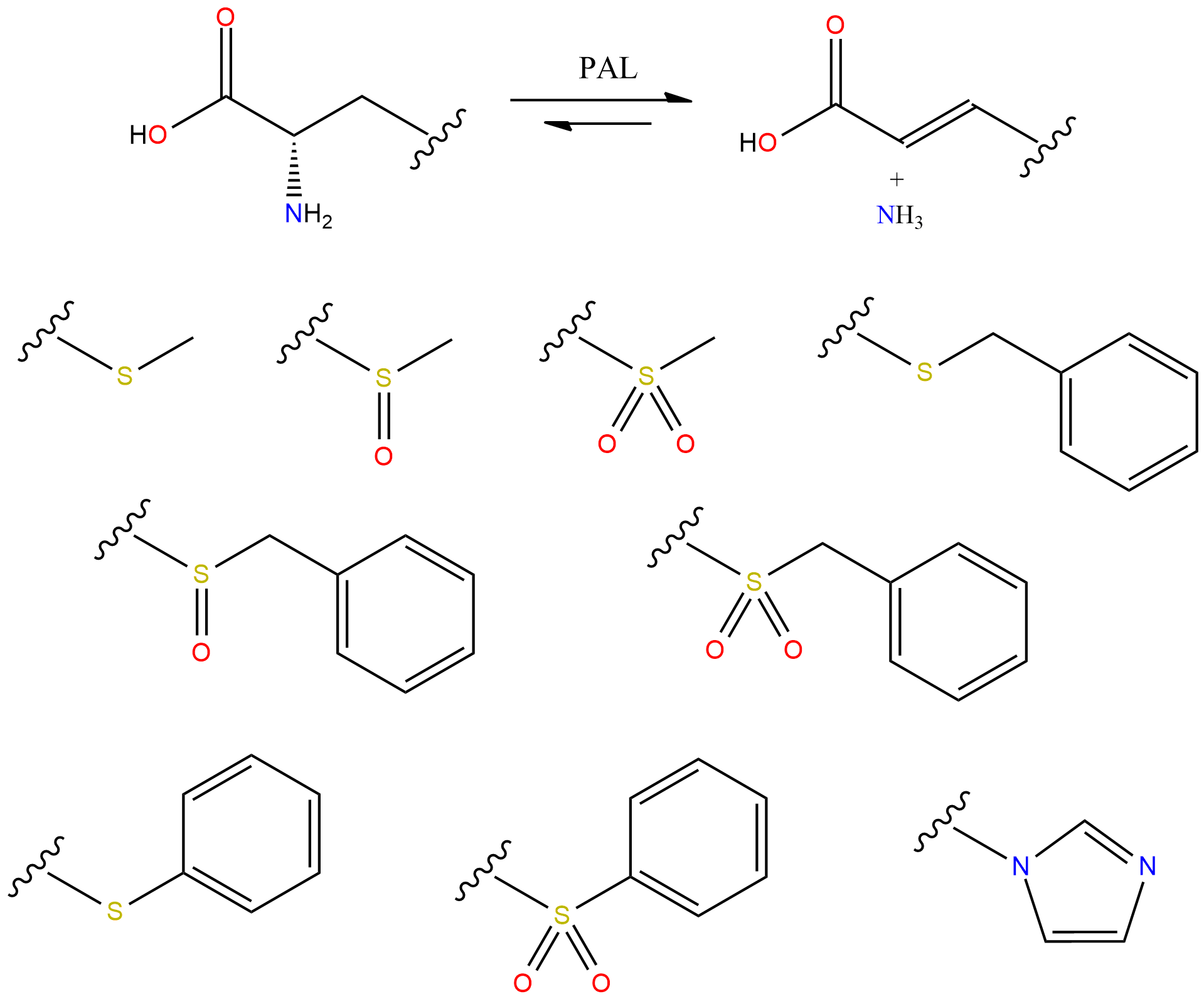
Egy konkrét, a kutatásom szempontjából is fontos példa az ipari jelentőségű enzimekre a fenilalanin ammónia-liáz (PAL), mely a természetben az L-fenilalanin nemoxidatív ammónia eliminációját katalizálja, mesterséges körülmények között azonban a sztereokonstruktív reverz reakció sikerrel alkalmazható. Jól példázza ezt az L-fenilanin és (S)-2-indolinkarbonsav[2] aszimmetrikus szintézise. Előbbi a mesterséges édesítőszer aszpartám, utóbbi a vérnyomáscsökkentő Perindopril intermedierje.
A PAL által katalizált ammónia addíció aromás akrilsavakra jól ismert, kutatócsoportunk azonban nemrég publikálta, hogy a petrezselyem PAL katalizálja az aciklusos L-propargilglicin átalakítását és előállítását is,[3] ezzel demonstrálva, hogy az aciklusos, elektronszívó csoportot tartalmazó oldalláncú aminosavakat is érdemes vizsgálni az enzim szubsztrátjaiként.
Munkám során tehát nemkonvencionális, elektronszívó csoportokkal β-szubsztituált alaninok előállítását illetve enzimkinetikai vizsgálatát tűztük ki célul. Ezt a könnyebben vizsgálható és követhető ammónia eliminációban, kísérleti és elméleti eszközökkel végeztük. Törekedtünk egy nagy áteresztőképességű eljárás kifejlesztésére, amely egy robusztus aminosav szintézisutat, és kis anyagmennyiségeket igénylő, automatizált spektrofotometriás és folyadékkromatográfiás-tömegspektrometriás enzimkinetikai méréseket foglal magába. Az enzimreakciók kinetikai viselkedését a szubsztrát jelöltek enzimmodellbe való indukált illeszkedésű kovalens dokkolásával, majd enzim-szubsztrát kölcsönhatásainak és energiaviszonyainak vizsgálatával próbáltunk értelmezni. A modellel kapott eredményeket összevetettük a méréseink során nyert adatokkal is.
[1] S. Aldridge; NatureBiotechnology, 2013 (31) 95–96.
[2] B. de Lange, D. J. Hyett, P. J. D. Maas, D. Mink, F. B. J. van Assema; ChemCatChem, 2011 (3) 289–292.
[3] D. Weiser, L. Cs. Bencze, G. Bánóczi, F. Ender, R. Kiss, E. Kókai, A. Szilágyi, B. G. Vértessy, Ö. Farkas, Cs. Paizs, L. Poppe; ChemBioChem, 2015 (16) 2283-2288.
szerző
-
Mihalovits Levente Márk
Gyógyszervegyész-mérnöki mesterképzési szak, nappali MSc
mesterképzés (MA/MSc)
konzulensek
-
Dr. Bánóczi Gergely
Posztdoktor, Babes-Bolyai Tudományegyetem (külső) -
Dr. Poppe László
egyetemi tanár, Szerves Kémia és Technológia Tanszék

